primeira fase:
1. Teoria Atômica: (Básico) Sobre a bancada de um laboratório encontram-se vários frascos contendo diversas substâncias com as seguintes etiquetas:
FeO – CO2 – CH4 – H2O – Fe2O3 – NO2
FeO – CO2 – CH4 – H2O – Fe2O3 – NO2
Forme um conjunto de substâncias, entre as relacionadas acima, que nos permita exemplificar a Lei de Dalton.
2. (Básico) Foram feitas cinco reações entre os gases nitrogênio e oxigênio (diatômicos), resultando cinco óxidos de nitrogênio gasosos. Os volumes coletados foram:
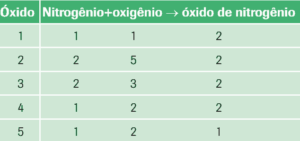
Dê as fórmulas dos cinco óxidos de nitrogênio.
3. (Básico) 1,5L de um gás A reagem totalmente com 3L de outro gás B, produzindo 3L de um gás AxBy. Admitindo que todos os volumes foram medidos nas mesmas condições de temperatura e pressão, determine os valores de x e y, sabendo que os gases A e B são diatômicos.
4. (Básico) Quantas moléculas de gás carbônico podem ser obtidas pela queima de 96g de carbono puro, conforme a reação: C + O2 CO2?
5. Teoria Atômica: (Básico) Quantas moléculas de gás oxigênio reagem com 6 mols de moléculas de monóxido de carbono, conforme a equação: CO + O2 CO2 ?
6. Teoria Atômica: (Básico) Dada a reação não-balanceada Fe + HC → → FeC → 3 + H2, qual o número de moléculas de gás hidrogênio produzidas pela reação de 112g de ferro?
7. (Básico) 5kg de CaCO3 são totalmente decompostos, conforme a reação química: CaCO3 CaO + CO2 . Calcule:
a) massa em kg de CaO obtido.
b) o volume de gás carbônico obtido a 25ºC e 1 atm, considerando que o volume molar é de 25L/mol.
a) massa em kg de CaO obtido.
b) o volume de gás carbônico obtido a 25ºC e 1 atm, considerando que o volume molar é de 25L/mol.
8. (Básico) Analise atentamente a equação abaixo, balanceada, para responder ao que se pede.
2 N2H4 + N2O4 → 3 N2 + 4 H2O
a) Em qual proporção, em número de moléculas, as substâncias envolvidas na reação se relacionam entre si?
b) Em qual proporção, em quantidade de matéria, se relacionam N 2H4 e N2?
c) Quantos mols de moléculas de H2O são produzidos quando a reação consome 5 mols de moléculas de N2H4?
d) Quantos mols de moléculas de N2 são produzidos juntamente com 12 mols de moléculas de H2O?
9. (Cesgranrio) Um funileiro usa um maçarico de acetileno para soldar uma panela. O gás acetileno (C2H2) é obtido na hora, através da seguinte reação química:
CaC2 + H2O → Ca(OH)2 + C2H2.
Qual a massa aproximada de carbureto de cálcio (CaC2) que será necessária para se obter 50L de acetileno nas CNTP?
10. (FEI) Dentre as seguintes substâncias: CO2, NH3, HC , H2O, NO2 e CO, a lei das proporções múltiplas pode ser exemplificada, usando o seguinte par:
a) H2O e HCl.
b) NH3 e NO2.
c) CO e CO2.
d) CO2 e NO2.
segunda fase
1) (Mack-2006) Na dissolução em água do cloreto de
hidrogênio gasoso (ou gás clorídrico), formam-se íons
H3O1+
e Cl 1–. A respeito desse fenômeno, fazem-se as
afirmações.
Dado: número atômico H = 1; O = 8; Cl = 17.
I) As moléculas do HCl, por serem polares, são atraídas
fortemente pelas moléculas de água.
II) Há a quebra da ligação covalente no HCl.
III) A reação é de ionização.
IV) O ânion produzido tem oito elétrons na última camada.
Estão corretas
a) I e II, somente.
b) I, III e IV, somente.
c) II e III, somente.
d) I, II e III, somente.
e) I, II, III e IV.
2) (Mack-2006) Átomos do elemento químico potássio, que
possuem 20 nêutrons, estão no quarto período da tabela
periódica, na família dos metais alcalinos.
Em relação a seus íons, é correto afirmar que
a) têm Z = 18.
b) têm 20 elétrons e A = 40.
c) têm 18 elétrons e A = 39.
d) são cátions bivalentes.
e) têm A = 38.
3) (UFMG-2007) Analise este quadro, em que se
apresenta o número de prótons, de nêutrons e de
elétrons de quatro espécies químicas:
Considerando-se as quatro espécies apresentadas, é
INCORRETO afirmar que
a) I é o cátion H+.
b) II é o ânion F -
c) III tem massa molar de 23 g / mol.
d) IV é um átomo neutro.
4) (PUC - RJ-2007) Assinale a afirmativa correta.
a) O nuclídeo Ar40
possui 18 prótons, 18 elétrons e 20
nêutrons.
b) Os nuclídeos U238
e U235
são isóbaros.
c) Os nuclídeos Ar40
e Ca40
são isótopos.
d) Os nuclídeos B11
e C12
são isótonos.
e) Os sais solúveis dos elementos da família dos alcalino
terrosos formam facilmente, em solução aquosa, cátions
com carga 1+.
5) (Mack-2007) Quando o primeiro isótopo do hidrogênio, cede
um elétron, resulta numa espécie química constituída
unicamente por
a) um nêutron.
b) um próton.
c) dois elétrons, igual ao He(Z=2).
d) um próton e um elétron.
e) um próton, um elétron e um nêutron.
6) (UEMG-2007) O desenvolvimento científico e
tecnológico possibilitou a identificação de átomos dos
elementos químicos naturais e também possibilitou a
síntese de átomos de elementos químicos não encontrados
na superfície da Terra.
Indique, entre as alternativas abaixo, aquela que identifica o
átomo de um determinado elemento químico e o diferencia
de todos os outros.
a) Massa atômica
b) Número de elétrons
c) Número atômico
d) Número de nêutrons
7) (ETEs-2009) As luzes de neônio são utilizadas em
anúncios comerciais pelo seu poder de chamar a atenção e
facilitar a comunicação. Essas luzes se aproveitam da
fluorescência do gás Neônio (Ne) mediante a passagem de
uma corrente elétrica. O neônio é um elemento químico de
símbolo Ne, número atômico 10 e número de massa 20.
Sobre esse elemento químico, considere as afirmações a
seguir.
I. Possui 10 prótons, 10 elétrons e 10 nêutrons.
II. Pertence à família dos metais alcalino-terroso e
apresenta 2 elétrons na última camada eletrônica.
III. Na última camada eletrônica de seus átomos,
encontram-se 8 elétrons.
É valido o contido em apenas
a) I.
b) II.
c) III.
d) I e II.
e) I e III.
8) (UERJ-1998) Há cem anos, foi anunciada ao mundo
inteiro a descoberta do elétron, o que provocou uma
verdadeira "revolução" na ciência. Essa descoberta
proporcionou à humanidade, mais tarde, a fabricação de
aparelhos eletroeletrônicos, que utilizam inúmeras fiações
de cobre.
A alternativa que indica corretamente o número de elétrons
contido na espécie química 29Cu2+ é:
A) 25
B) 27
C) 31
D) 33
9) (Mack-2002) O alumínio que tem número atômico igual
a 13:
a) pertence ao grupo 1A da tabela periódica.
b) forma cátion trivalente.
c) tem símbolo Am.
d) pertence à família dos metais alcalino-terrosos.
e) é líqüido à temperatura ambiente.
10) (PUC - RS/2-2001) Os metais alcalinos-terrosos, à
temperatura e pressão ambiente, são sólidos prateados, de
baixa dureza, e reagem facilmente com a água e o oxigênio
do ar. À medida que aumenta o número atômico desses
metais,
A) aumenta a energia de ionização.
B) diminui o número de oxidação.
C) diminui o caráter metálico.
D) aumenta a afinidade eletrônica.
E) diminui a eletronegatividade.
11) (PUC - RS/1-2002) O átomo, na visão de Thomson, é
constituído de
A) níveis e subníveis de energia.
B) cargas positivas e negativas.
C) núcleo e eletrosfera.
D) grandes espaços vazios.
E) orbitais.
12) (PUC - RS/1-2002) A espécie química que apresenta 52
prótons, 75 nêutrons, 54 elétrons é:
A) 52Cr2+
B) 112Cd2+
C) 186Re2-
D) 131Xe
E) 127Te2-
respostas:
Gabarito
1) Alternativa: E
2) Alternativa: C
3) Alternativa: D
4) Alternativa: D
5) Alternativa: B
6) Alternativa: C
7) Alternativa: E
8) Alternativa: B
9) Alternativa: B
10) Alternativa: E
11) Alternativa: B
12) Alternativa: E
baixa aqui os exercicios completos
Atomistica Exercicios
 Reviewed by Celso Rui
on
abril 29, 2020
Rating:
Reviewed by Celso Rui
on
abril 29, 2020
Rating:
 Reviewed by Celso Rui
on
abril 29, 2020
Rating:
Reviewed by Celso Rui
on
abril 29, 2020
Rating:





Sem comentários: