A composição da matéria é estudada desde a Antiguidade, mais especificamente desde o século V a.C., quando os filósofos gregos Leucipo e Demócrito propuseram a explicação de que a matéria era constituída de pequenas partículas que não poderiam ser divididas e deram a essas partículas o nome de átomos.
Essa teoria vigorou por vários anos, até que o químico e físico inglês John Dalton, por volta de 1808, após estudos baseados nas leis ponderais e em experimentos, propôs que a matéria era formada por partículas de formato esférico, indivisível e sem carga.
Dentro dessa perspectiva, átomos que tivessem as mesmas características e propriedades seriam do mesmo elemento químico e sofreriam um rearranjo quando realizassem uma reação química. Esse modelo ficou conhecido como bola de bilhar, por ser esférico e maciço. Para saber mais sobre, leia: Modelo atômico de Dalton.
Com a diversificação das pesquisas e o aprofundamento dos experimentos, foram surgindo outros modelos mais plausíveis e que possibilitavam a explicação de outros fenômenos.
Assim, foi em 1887 que o físico britânico Joseph John Thomson alterou a ideia de partícula indivisível que se fazia do átomo. Por meio de experimentos com raios catódicos, ele descobriu o elétron, uma partícula de carga negativa que está presente na estrutura atômica.
Para explicar o caráter neutro da matéria, ele indicou que o átomo seria uma massa positiva, com os elétrons distribuídos uniformemente. Esse modelo ficou conhecido como o pudim de passas. Para saber mais sobre, leia: Modelo atômico de Thomson.
.jpg)
Em 1911, o físico Ernest Rutherford, nascido na Nova Zelândia, descobriu que o átomo não era uma esfera maciça, como indicavam os outros modelos, e sim uma estrutura com grandes espaços vazios. Ele fez essa descoberta após realizar experimentos para entender um pouco mais sobre a radioatividade e as partículas alfa, tendo sido essas, para tanto, bombardeadas em uma fina lâmina de ouro.
Nesse experimento, Rutherford pôde observar que algumas partículas alfa não atravessavam a lâmina de ouro, outras sofriam um desvio na trajetória, e a maioria delas passava direto, sem alteração na direção.
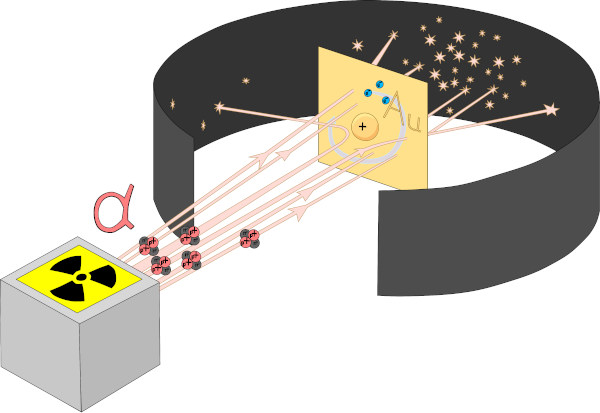
Experimento de Rutherford em que partículas alfa foram bombardeadas em uma fina camada de ouro.
Após essas observações, Rutherford concluiu que o átomo era composto por um núcleo denso e positivo, em que estavam contidos os prótons, e os elétrons orbitavam ao redor do núcleo em um grande espaço vazio, chamado eletrosfera. Essa descrição lembra o Sistema Solar, nome pelo qual se designou esse modelo atômico. Para saber mais sobre, leia: Modelo atômico de Rutherford.
.jpg)
O modelo atômico de Rutherford é conhecido como o modelo planetário.
Baseado no modelo atômico de Rutherford, o físico dinamarquês Niels Bohr propôs uma reformulação do modelo atômico, e, assim, em 1913, surgiu o modelo de Bohr (em alguns casos, também chamado de Rutherford-Bohr), que explicava como os elétrons estavam distribuídos na eletrosfera. Para tanto, elaborou alguns postulados, a fim de descrever sua teoria:
- Os elétrons movimentam-se ao redor do núcleo em órbitas circulares e com energias definidas, denominadas camadas eletrônicas.
- Cada camada possui uma energia permitida para os elétrons, a qual aumenta à medida que se distancia do núcleo. Os elétrons não perdem ou ganham energia espontaneamente ao movimentarem-se na camada.
- Os elétrons podem absorver energia e saltar para uma camada mais externa, porém de maneira instável. Quando o elétron retorna para sua camada de origem, ele emite a energia absorvida na forma de luz ou calor. Esse fenômeno é denominado salto quântico.
.jpg)
O modelo atômico de Bohr considerou os níveis de energia em que os átomos orbitavam ao redor do núcleo.
Exercício resolvido
(Enem) Os núcleos dos átomos são constituídos de prótons e nêutrons, sendo ambos os principais responsáveis pela sua massa. Nota-se que, na maioria dos núcleos, essas partículas não estão presentes na mesma proporção. O gráfico mostra a quantidade de nêutrons (N) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos.
.png)
Gráfico com quantidade de prótons e nêutrons. (Foto: Reprodução/Enem)
O antimônio é um elemento químico que possui 50 prótons e possui vários isótopos ― átomos que só se diferem pelo número de nêutrons. De acordo com o gráfico, os isótopos estáveis do antimônio possuem
a) entre 12 e 24 nêutrons a menos que o número de prótons.
b) exatamente o mesmo número de prótons e nêutrons.
c) entre 0 e 12 nêutrons a mais que o número de prótons.
d) entre 12 e 24 nêutrons a mais que o número de prótons.
e) entre 0 e 12 nêutrons a menos que o número de prótons.
Analisando o gráfico, mais precisamente na linha dos 50 prótons, percebe-se que os isótopos possuem de 62 a 74 nêutrons, isto é, de 12 a 24 nêutrons a mais que o número de prótons do antimônio.
Gabarito:
Por Victor Felix
Graduado em Química
Graduado em Química

baseado em: brazilescola
História do atmo
![História do atmo]() Reviewed by Celso Rui
on
abril 19, 2020
Rating:
Reviewed by Celso Rui
on
abril 19, 2020
Rating:





Sem comentários: